Propriétés du Nickel dans le tableau périodique
Structure atomique du nickel
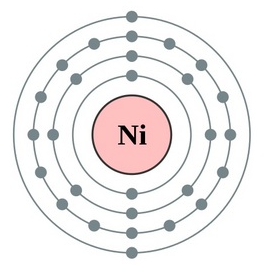
Le nickel possède un numéro atomique de 28, ce qui signifie que son noyau contient 28 protons. Sa configuration électronique est [Ar] 3d8 4s2, ce qui indique qu'il a 28 électrons répartis sur quatre couches électroniques. Les électrons de la couche 3d lui confèrent ses propriétés métalliques et son rôle dans les réactions chimiques.
L'atome de nickel a une masse atomique moyenne d'environ 58,69 u. Il possède cinq isotopes naturels, dont le nickel-58, qui est le plus abondant. Sa structure cristalline est de type cubique à faces centrées (CFC), ce qui lui confère une grande ductilité et une conductivité thermique élevée.
Répartition des isotopes
Les isotopes stables du nickel comprennent le nickel-58, le nickel-60, le nickel-61, le nickel-62 et le nickel-64. Ces isotopes sont présents en quantités variables, le nickel-58 représentant environ 68 % de l'abondance isotopique naturelle. Le nickel est également produit de manière artificielle dans des réacteurs nucléaires pour des applications spécialisées.
Propriétés physiques du nickel
Le nickel est un métal de transition dense avec une densité d'environ 8,90 g/cm³ à température ambiante. Il fond à une température de 1 455 °C et bout à 2 913 °C, ce qui le rend adapté aux environnements à haute température. Sa conductivité thermique et électrique est modérée par rapport à d'autres métaux comme le cuivre, mais reste suffisante pour de nombreuses applications industrielles.
Le nickel se distingue également par sa résistance à la corrosion et à l'oxydation. Lorsqu'il est exposé à l'air, il forme une fine couche d'oxyde qui protège le métal sous-jacent des agressions chimiques. Cette propriété est exploitée dans les alliages résistants à la corrosion comme l'inox.
Propriétés chimiques du nickel
Le nickel est un élément réactif, bien qu'il ne se corrode pas facilement grâce à sa couche d'oxyde protectrice. Il réagit avec les halogènes pour former des halogénures de nickel, comme le chlorure de nickel (NiCl2), souvent utilisé dans la galvanoplastie. En présence d'acides puissants comme l'acide sulfurique ou l'acide chlorhydrique, le nickel libère de l'hydrogène.
Dans les réactions redox, le nickel peut adopter plusieurs états d'oxydation, bien que +2 soit le plus courant. Cet état lui permet d'agir comme catalyseur dans des processus tels que l'hydrogénation des graisses et des huiles. Il est également utilisé dans les batteries rechargeables comme les batteries NiMH (nickel-hydrure métallique) et NiCd (nickel-cadmium).
Alliages et applications chimiques
Les alliages de nickel sont largement utilisés dans l'industrie. Par exemple, l'inox, un alliage de nickel et de fer avec une teneur variable en chrome, est indispensable pour la fabrication d'ustensiles de cuisine, d'équipements médicaux et de composants architecturaux. Les superalliages contenant du nickel résistent à des conditions extrêmes, notamment dans les moteurs d'avions et les turbines à gaz.
Le nickel est également essentiel dans la production de catalyseurs chimiques. Ces derniers accélèrent des réactions importantes, comme le reformage du méthane pour produire de l'hydrogène ou la synthèse de composés organiques complexes dans l'industrie pharmaceutique.