Propriétés de l’Azote dans le tableau périodique
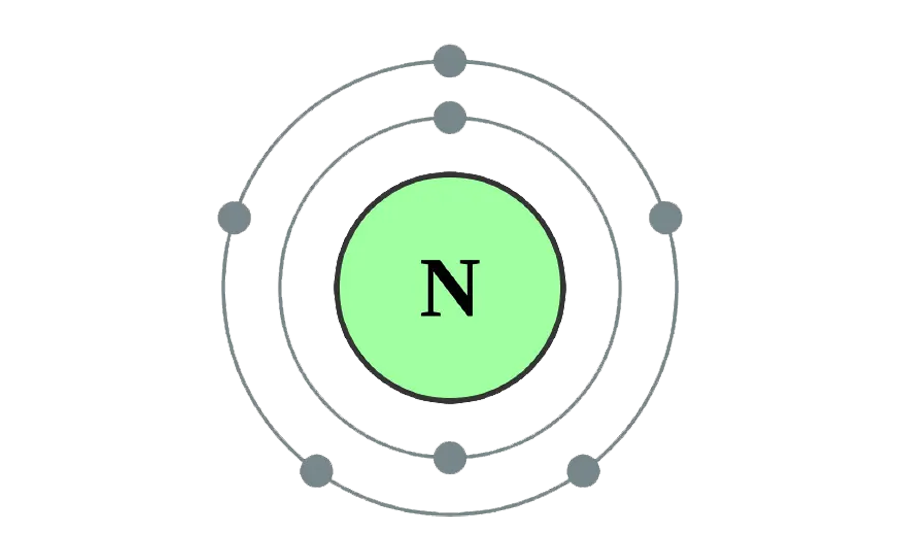
Structure atomique de l'azote
L'atome d'azote possède un numéro atomique de 7, ce qui signifie qu'il contient sept protons dans son noyau. L'arrangement électronique de cet élément est 1s² 2s² 2p³, ce qui reflète sa configuration électronique stable. Avec cinq électrons de valence dans sa couche externe, l'azote montre une forte tendance à former des liaisons covalentes en partageant des électrons pour compléter sa couche de valence. L'une des caractéristiques distinctives de l'azote est sa capacité à former une triple liaison très robuste avec lui-même, comme on l'observe dans la molécule diatomique N₂.
La triple liaison de la molécule N₂ est particulièrement stable, ce qui en fait l'une des liaisons covalentes les plus solides dans la nature. Cette stabilité explique la faible réactivité chimique de l'azote moléculaire à température ambiante. En revanche, la rupture de cette liaison, qui exige des conditions spécifiques comme une température ou une pression élevées, libère une grande quantité d'énergie.
Propriétés physiques de l'azote
À température ambiante, l'azote est un gaz inodore, incolore et non toxique dans sa forme diatomique. Son point d'ébullition est de -195,8 °C et son point de fusion de -210 °C. Ces températures très basses rendent l'azote liquide particulièrement utile dans des applications cryogéniques, comme la conservation de tissus biologiques ou la congélation rapide d'aliments.
En phase liquide, l'azote est également employé comme réfrigérant en raison de sa capacité à maintenir des températures extrêmement basses. Dans les laboratoires, il est souvent utilisé pour créer des environnements inertes, empêchant les réactions indésirables dues à l'oxygène atmosphérique.
Caractéristiques chimiques de l'azote
Réactivité chimique
L'azote moléculaire, sous sa forme N₂, est relativement inerte en raison de la stabilité de sa triple liaison. Cependant, il peut réagir dans des conditions spécifiques, notamment pour former des composés tels que l'ammoniac (NH₃) par le procédé Haber-Bosch, une étape essentielle dans la production d'engrais. L'azote entre également dans la composition de nombreux oxydes d'azote, tels que NO, NO₂ et N₂O, qui jouent des rôles cruciaux dans les cycles atmosphériques et environnementaux.
Composés et applications
Les composés azotés se trouvent dans de nombreuses substances biologiques et chimiques essentielles. Les acides aminés, constituants de base des protéines, contiennent de l'azote. Les bases azotées sont également des éléments clés des acides nucléiques tels que l'ADN et l'ARN. Dans l'industrie, les nitrates sont employés dans la fabrication d'explosifs, tandis que les composés organiques azotés servent de précurseurs pour divers produits chimiques.
Dans le domaine médical, l'azote liquide est utilisé pour la cryothérapie, où il détruit des tissus anormaux tels que les verrues. Les oxydes d'azote trouvent leur application dans l'anesthésie, notamment le protoxyde d'azote (N₂O), couramment appelé gaz hilarant.
Rôle de l'azote dans le tableau périodique
L'azote appartient au groupe 15 du tableau périodique, connu sous le nom de groupe des pnictogènes. Sa position dans la deuxième période reflète sa petite taille atomique et sa forte électronégativité (3,04 sur l'échelle de Pauling). Cette électronégativité élevée permet à l'azote de former des liaisons polaires avec des éléments moins électronégatifs, comme l'hydrogène ou le carbone.
Son rôle dans les cycles biogéochimiques, tels que le cycle de l'azote, est fondamental pour la vie. Les processus de fixation, nitrification, et dénitrification impliquent l'azote dans des transformations complexes entre formes organiques et inorganiques, assurant ainsi son recyclage dans les écosystèmes terrestres et aquatiques.
Importance industrielle et écologique
En agriculture, l'azote est une composante clé des engrais, permettant de soutenir la croissance des cultures. Sa conversion en ammoniac, puis en nitrates ou urée, alimente les sols en nutriments essentiels. Dans un contexte environnemental, l'azote atmosphérique aide à réguler les températures globales, mais certains de ses oxydes contribuent également aux phénomènes de pollution et de changement climatique.
Dans les industries chimiques et pharmaceutiques, il est employé pour la production d'éléments essentiels, depuis les plastiques jusqu'aux médicaments. Enfin, la capacité de l'azote à créer des environnements inertes trouve des applications dans le stockage et le transport de produits sensibles.